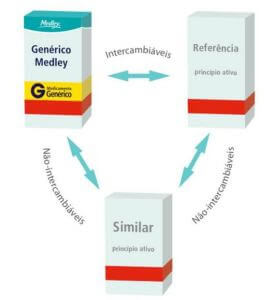
Desde 2003, o medicamento similar passou a começar a apresentar os mesmos testes de biodisponibilidade relativa e equivalência farmacêutica do que os genéricos, podendo então ser intercambiado com o medicamento de referência.
Então, em 1° de janeiro de 2014 entrou em vigor a RDC n° 58 da ANVISA, que possibilita a intercambialidade (troca segura e efetiva) entre medicamentos similares e referência.
Como a já realizada entre medicamentos referência e genéricos, e sua lista anexa descreve quais os medicamentos similares que apresentaram estes estudos, podendo ser então intercambiados.
Como a intercambialidade funciona na prática
Na prática, esta resolução possibilitou que aqueles medicamentos similares que possuíssem as devidas comprovações, pudessem pleitear intercambialidade e se categorizassem como Similares Bioequivalentes ou Intercambiáveis (praticamente uma nova sub-classe).
Mas é necessário cautela – não são todos os similares que podem ser intercambiados! Periodicamente a Anvisa está publicando nova lista, adicionando os medicamentos e suas devidas formas farmacêuticas que já podem ser intercambiadas.
A lista de medicamentos similares intercambiáveis é atualizada frequentemente através do anexo da referida legislação, e você pode acessá-la clicando aqui.
Todos os laboratórios interessados tinham o prazo de dezembro de 2014 para apresentar os estudos de equivalência farmacêutica, biodisponibilidade relativa e bioequivalência de seus já registros medicamentos similares, para assim poderem ser intercambiáveis (como os genéricos são).
Contudo, grande parte dos laboratórios foram apresentando os testes e sendo aprovados pela Anvisa aos poucos e continuamente, motivo pelo qual essa lista anexa é atualizada frequentemente.
Antes desta resolução, só era possível a intercambialidade entre medicamentos referência e medicamentos genéricos, e vice-versa, sendo este processo regido pelas Leis nº 9787/94, pela RDC n° 135/2013 e pela RDC nº 58/2014 da ANVISA.
Cabe frisar que o intercâmbio/ troca de medicamentos, assim como a dispensação de controlados e grande parte dos serviços farmacêuticos, é atividade privativa do farmacêutico, não podendo ser nem delegada ou transferida.
Ela deve ser registrada no verso da receita e autorizada pelo mesmo, conforme preconizado pela legislação – ou ainda em uma Declaração de Serviço Farmacêutico.
Como ficava a intercambialidade antes da RDC 58/2014
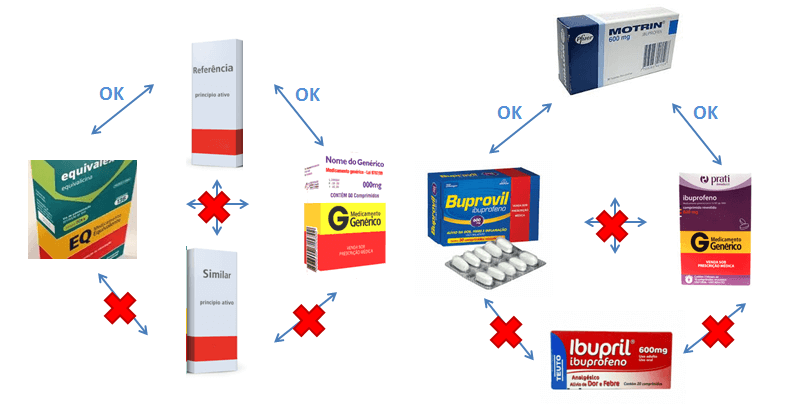
Como fica depois da RDC 58/2014
Alertamos que, segundo a RDC nº 51 de 2007 da ANVISA, no âmbito do Sistema Único de Saúde – SUS os responsáveis pelas prescrições devem adotar obrigatoriamente a Denominação Comum Brasileira (DCB), ou na sua falta, a DCI.
Já nos serviços privados de saúde, a prescrição ficará a critério do prescritor, que pode utilizar o nome genérico ou comercial, na falta de DCB.
Caso tenha alguma restrição à substituição do medicamento de marca pelo genérico correspondente, o prescritor deve manifestar claramente sua decisão, de próprio punho, de forma clara, incluindo no receituário uma expressão como “Não autorizo a substituição”.
É importante ressaltar que a prescrição aberta, ou seja, que apresenta alternativamente a DCB, DCI e mais de uma opção de nomes comerciais de produtos e medicamentos amplia o leque de oportunidades para aquisição dos medicamentos pelo paciente, garantindo maior possibilidade de acesso ao tratamento prescrito.
Em tempos de pandemia da COVID-19, caracterizados pela restrição econômica, logística e de locomoção, diminuir as lacunas no processo de adesão e facilitar a adesão ao tratamento é crucial para garantirmos a recuperação, promoção e alcance da saúde e metas terapêuticas de nossos pacientes.
Além disso, a intercambialidade pode ser uma alternativa importante para enfrentamento das rupturas de estoque oriundas dos impactos econômicos e logísticas da pandemia.
Tanto para o paciente (que muitas vezes está procurando alternativas economicamente mais viáveis para seu tratamento, ou mesmo disponibilidade destes) quanto para a farmácia (que nem sempre possui a disposição todas as opções em seu mix, seja fruto de baixa demanda ou de rupturas pontuais dos fornecedores).
Proporcionar liberdade e colocar o paciente no centro do processo decisório de saúde são direitos e prerrogativas dos pacientes e cidadãos.
Dica: você deve ter a listagem atualizada impressa a disposição de seus atendentes e dos órgãos fiscalizadores. Contudo, trata-se de uma listagem extremamente extensa e cansativa de usar. Crie uma que leve em conta o mix de medicamentos de sua farmácia, organize em um material mais didático e fácil de usar e visualizar – pode ser um ótimo meio de não perder vendas e de deixar de disponibilizar tratamento para seus paciente-clientes!
Em novembro de 2014 fui entrevistado sobre o tema, pelo Jornal do Comercio, segue o link – Medicamentos similares – Jornal do Comércio: http://youtu.be/vgdVVdcTJlc .
Revisão Rápida sobre tipos de Medicamentos (quanto ao registro junto a ANVISA)
- Referência –é o medicamento inovador registrado no órgão federal responsável pela vigilância sanitária e comercializado no País, cuja eficácia, segurança e qualidade foram comprovadas cientificamente junto ao órgão federal competente, por ocasião do registro. A eficácia e segurança do medicamento de referência são comprovadas através de apresentação de estudos clínicos.
- Genérico– é o medicamento equivalente a um produto de referência ou inovador, que se pretende ser com este intercambiável, geralmente produzido após a expiração ou renúncia da proteção patentária ou de outros direitos de exclusividade, comprovada a sua eficácia, segurança e qualidade, e designado pela DCB ou, na sua ausência, pela DCI. Possui os mesmos padrões farmacológicos e de qualidade que o medicamento de referência.
- Similar – medicamento similar é aquele que contém o mesmo ou os mesmos princípios ativos, mesma concentração, forma farmacêutica, via de administração, posologia e indicação terapêutica, podendo diferir somente em algumas características. Tem nome comercial ou marca.
- Similar Bioequivalente– Desde 2003, o medicamento similar passou a começar a apresentar os mesmos testes de biodisponibilidade relativa e equivalência farmacêutica do que os genéricos, e que pode ser intercambiado com o medicamento de Referência. Estão listados pelos anexos da RDC nº 58/2014 da ANVISA.
- Se na prescrição constar Motrin 600mg (que é referência para o princípio ativo Ibuprofeno 600mg), dispensar 10 cp e tomar 1 cp de 12 em 12h, e todos os requisitos da prescrição estiverem corretos e claros (e o médico não vetar a intercambialidade por escrito na prescrição), o farmacêutico pode optar pela intercambialidade com:
I – Ibuprofeno 600 mg Genérico;
II – Buprovil 600mg (que é similar bioequivalente e consta na listagem).
Ou poderia optar pela dispensação do próprio Motrin 600 mg, sempre com o consentimento e escolha do próprio paciente! - Se na prescrição constar Ibuprofeno 600mg(que é a DCB deste, ou nomenclatura genérica), dispensar 10 cp e tomar 1 cp de 12 em 12h, e todos os requisitos da prescrição estiverem corretos e claros (e o médico não vetar a intercambialidade por escrito na prescrição), o farmacêutico pode optar pela intercambialidade com:
I – Motrin 600mg (que é referência para o princípio ativo ibuprofeno 600mg).
Ou poderia optar pela dispensação de qualquer genérico do Ibuprofeno 600 mg, sempre com o consentimento e escolha do próprio paciente!
O farmacêutico NÃO poderia trocar por qualquer outro similar ou similar bioequivalente!
- Se na prescrição constar Buprovil 600mg(que é a similar bioequivalente do Motrin 600mg), dispensar 10 cp e tomar 1 cp de 12 em 12h, e todos os requisitos da prescrição estiverem corretos e claros (e o médico não vetar a intercambialidade por escrito na prescrição), o farmacêutico pode optar pela intercambialidade com:
I – Motrin 600mg (que é referência para o princípio ativo ibuprofeno 600mg).
Ou poderia optar pela dispensação do próprio Buprovil 600 mg, sempre com o consentimento e escolha do próprio paciente!
O farmacêutico NÃO poderia trocar por qualquer outro similar ou genérico do Ibuprofeno 600mg!
- Se na prescrição constar Ibupril 600mg(que é similar e não consta na listagem de similares bioequivalentes), dispensar 10 cp e tomar 1 cp de 12 em 12h, e todos os requisitos da prescrição estiverem corretos e claros (e o médico não vetar a intercambialidade por escrito na prescrição), o farmacêutico farmacêutico NÃO poderia trocar por qualquer outro medicamento (seja similar, referência ou similar bioequivalente).
- Se na prescrição constar Motrin ou Ibuprofeno 600mg(que são respectivamente o Referência e o Genérico do Ibuprofeno 600mg), dispensar 10 cp e tomar 1 cp de 12 em 12h, e todos os requisitos da prescrição estiverem corretos e claros (e o médico não vetar a intercambialidade por escrito na prescrição), o farmacêutico pode optar pela intercambialidade com:
I – Qualquer marca genérico de Ibuprofeno 600mg
II – Qualquer marca similar bioequivalente (pois consta na receita o medicamento referência)
III – Optar por qualquer marca referência do Ibuprofeno 600mg.
Toda e qualquer escolha deve se dar com consentimento e escolha do próprio paciente!
O farmacêutico NÃO pode trocar por qualquer outro similar que não fosse similar bioequivalente!







